Die Situation rund um die Bilateralen Abkommen und das MRA (Mutual recognition agreement) zwischen EU und der Schweiz schärft sich weiter zu. Schweizer Hersteller sind unter enormen zeitlichen Druck, um Ihre Produkte in Europa weiterhin verkaufen zu dürfen.
Gemäss neuesten Informationen wird es nicht möglich sein, das MRA vor dem DOA (Date of application) der MDR zu erneuern.
Die folgenden Artikel wurden gestern publiziert und beschreiben die Situation:
- https://www.nzz.ch/schweiz/schweizer-medizinaltechnik-eu-erhoeht-den-druck-ld.1534093
- https://www.tagesanzeiger.ch/schweiz/standard/am-wef-soll-der-bundesrat-die-medtechbranche-retten/story/26281637
Mögliche Szenarien
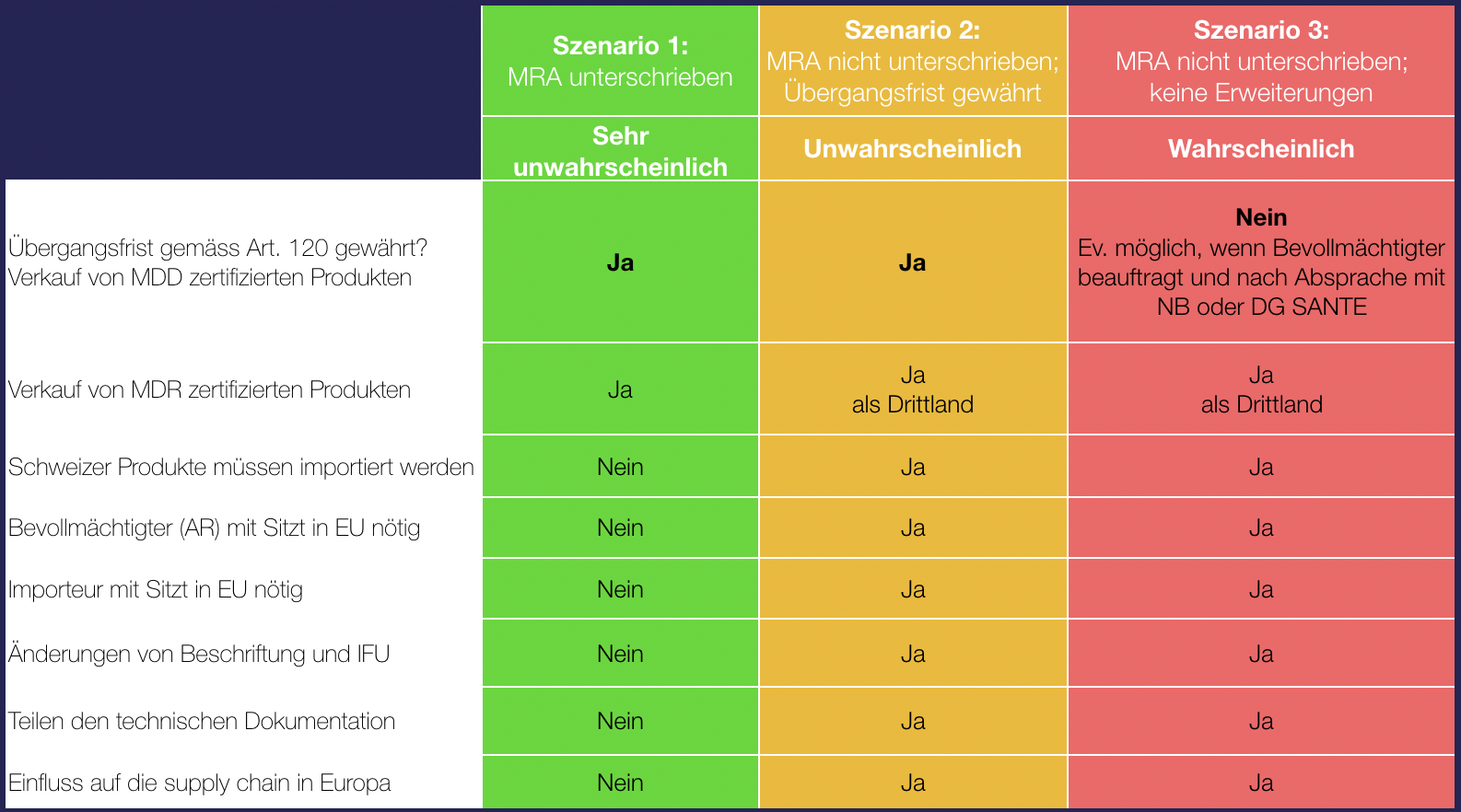
Swiss Medtech hat mögliche Szenarien publiziert:
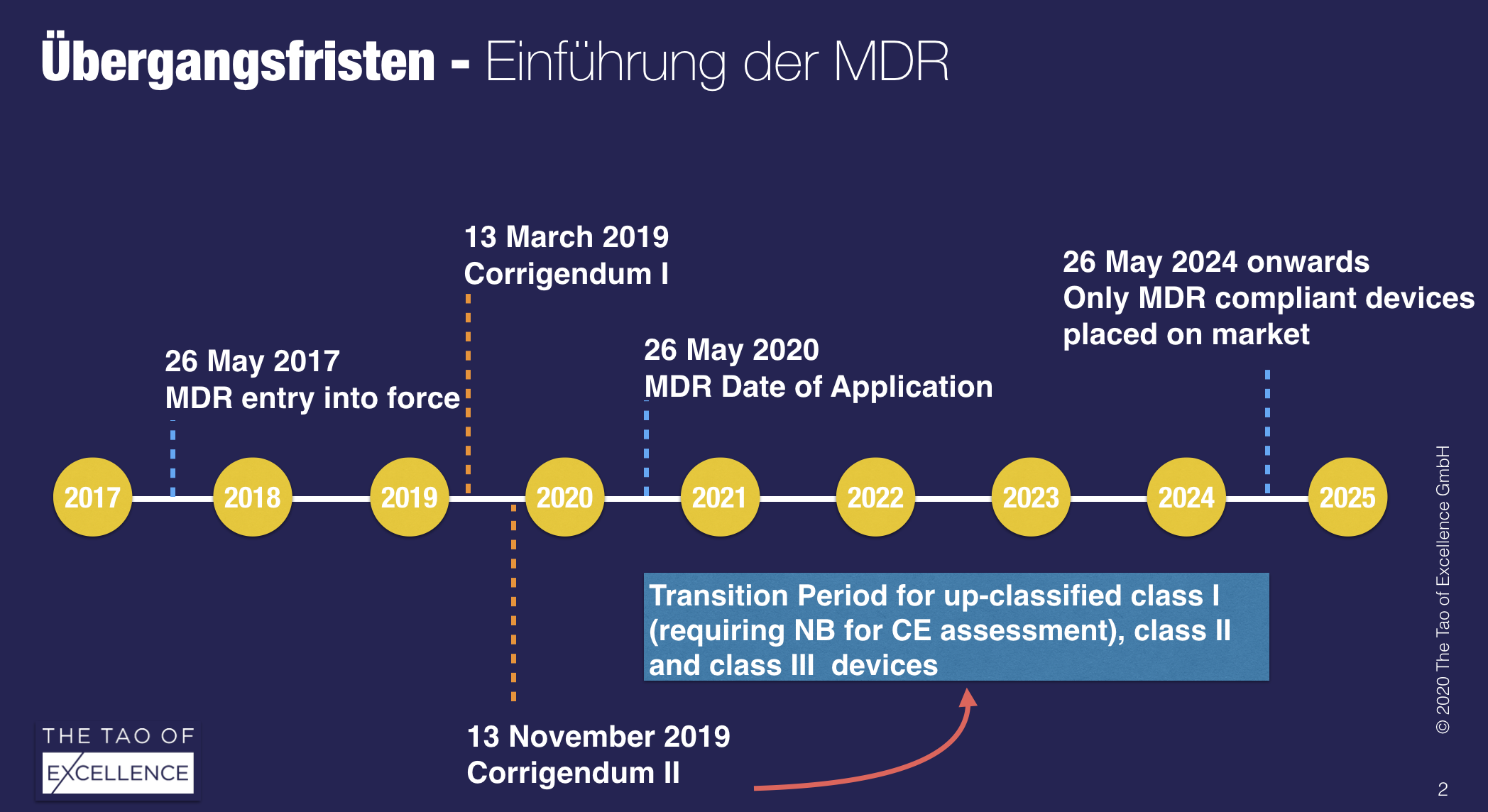
Es ist nun das befürchtete Worst-case Szenario das wahrscheinlichste. Dadurch ist es wahrscheinlich, dass für Medizinprodukte von Schweizer Herstellern keine Übergangsfrist für die MDR gewährt wird und die MDD-zertifizierten Produkte nicht mehr verkauft werden dürfen. Die Situation ist durch das Korrigendum 2 für Schweizer Hersteller nicht entschärft.
Wir haben die gegenwärtigen Szenarien für Sie zusammengestellt:
Wer ist betroffen?
Sie sind davon betroffen, wenn Sie die folgenden Fragen mit ‘ja’ beantworten.
- Sind Sie ein Hersteller von Medizinprodukten gemäss MDR?
- Sind Sie ein Schweizer Inverkehrsbringer?
- Verkaufen Sie Medizinprodukte nach Europa?
- Ist der europäische Markt für Sie geschäftlich relevant?
Was ist jetzt zu tun?
Werden Sie aktiv! Bereiten Sie sich auf das Szenario 3 vor. Die beste Ausgangslage haben Sie, wenn noch vor dem 26. Mai 2020 Sie einen Bevollmächtigten in der EU beauftragen.
- Analysieren Sie das Portfolio mit der Geschäftsperspektive neu
- Evaluieren Sie Ihre Lieferkette in der EU und passen Sie sie entsprechend an.
- Arbeiten Sie mit Ihrem Distributor um zu sehen ob er die Rolle als Importeur, resp. Bevollmächtigter übernehmen kann. Wenn nicht, finden Sie einen Bevollmächtigten in der EU.
- Sprechen Sie sich mit Ihrem NB ab, ob er mit der Übergangsfrist durch den beauftragten Bevollmächtigten einverstanden ist.
- Stellen Sie alle Verpflichtungen des Bevollmächtigten fest und einigen Sie sich einvernehmlich auf den Vertrag.
- Planen Sie Ihre Bestände an MDD / MDR-zertifizierten Geräten. Achtung: Im schlimmsten Fall kann ab dem 27. Mai 2020 kein MDD / MDR-Gerät auf dem europäischen Markt in Verkehr gebracht warden.
- Planen Sie, den Namen und die Adresse des Bevollmächtigten in das Etikett und IFU aufzunehmen.
- Definieren Sie den Prozess der regelmäßigen Aktualisierung und Weitergabe der Kopie der technischen Dokumentation an den Bevollmächtigten.
- Richten Sie den Prozess für die Kommunikation mit dem Bevollmächtigten ein:
- Anforderung von Behörden.
- Beschwerden und Berichten von Angehörigen der Gesundheitsberufe und der Patienten.
- Korrektur- und Vorbeugungsmassnahmen, um die vom Gerät ausgehenden Risiken zu verringern.
Kontaktieren Sie uns, wenn Sie Fragen dazu haben und wenn Sie besprechen möchten, wie das beste Vorgehen für Sie in Ihrem Fall ist. Wir stehen Ihnen gerne zur Verfügung:
 Jasminka Roth
Jasminka Roth
Founder and Director
Phone
+41 52 685 51 65
Email
[email protected]
 Deepa Rajagopalan
Deepa Rajagopalan
Quality Implementation Manager
Phone
+41 52 685 51 65
Email
[email protected]
Did you like this article? Follow us on LinkedIn and Twitter!